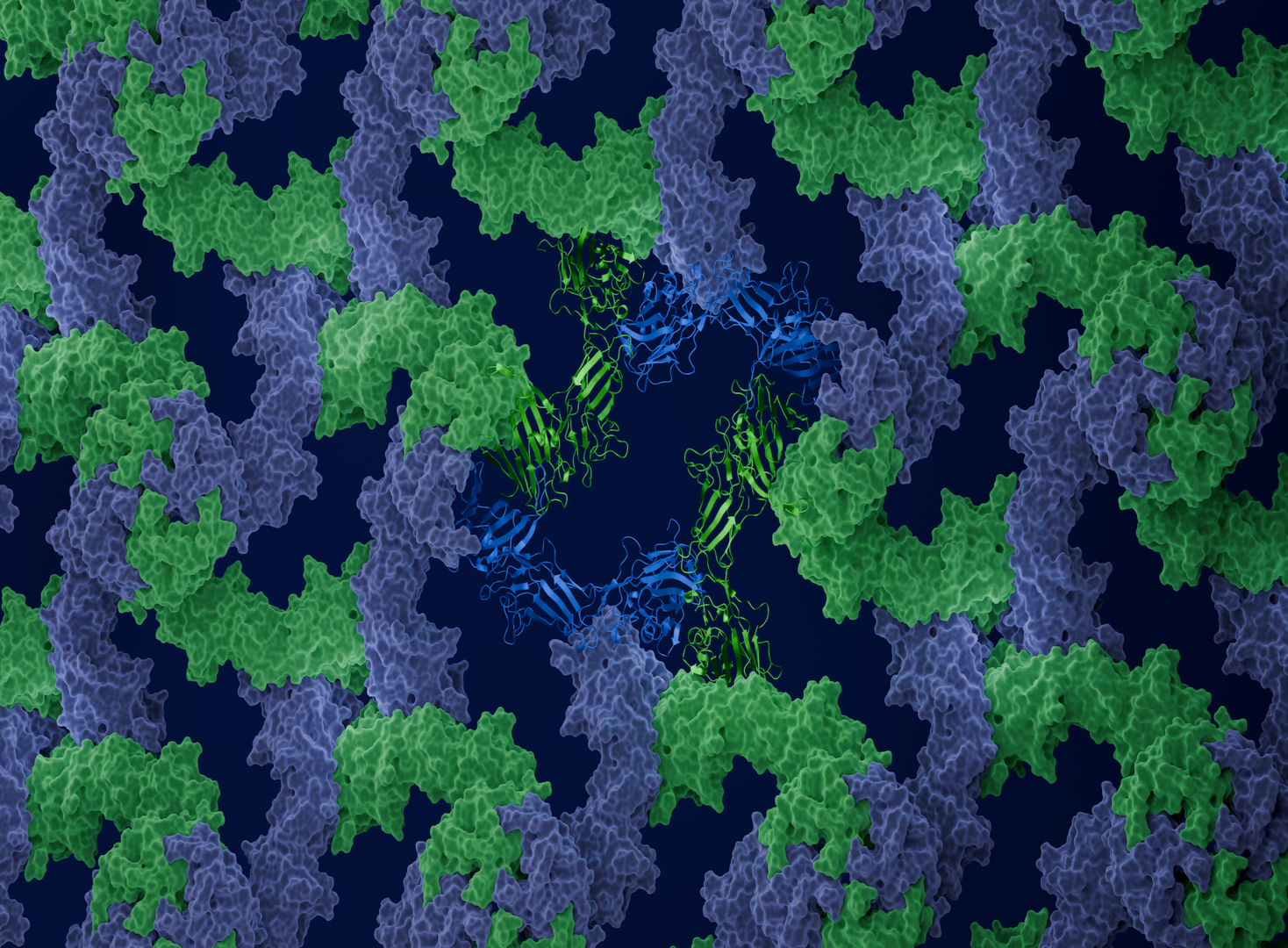
Wofür Forscher:innen im Labor bisher Monate oder gar Jahre gebraucht haben, das lässt sich nun am Computer in wenigen Stunden berechnen. „Wir haben mit SymProFold eine Methode entwickelt und optimiert, mit der wir in kurzer Zeit die Struktur von komplexen regelmäßigen Protein-Assemblierungen berechnen können“, berichten Christoph Buhlheller und Theo Sagmeister vom Institut für Molekulare Biowissenschaften der Uni Graz. Alles, was Forscher:innen dazu brauchen, ist eine Sequenz des Proteins, aus dem das Gitter aufgebaut ist. Die Bestätigung der errechneten Struktur im Labor sichert das Ergebnis ab. Durch das rechnerisch erworbene Vorwissen können die Experimente zielgerichtet durchgeführt werden, wodurch wertvolle Zeit eingespart wird.
Schlüssel zum Nano-Design für Medizin und Technik
Jede Art von Virus, Archaea oder Bakterium hat eine eigene Oberflächenstruktur. Virenhüllen werden Capside genannt, jene von Bakterien und Archaea S-Layer - S für surface, deutsch Oberfläche. Letztere sind besonders komplexe, supramolekulare Gebilde. „Wenn wir genau wissen, wie diese Strukturen aussehen, kennen wir auch ihre Stärken und Schwächen“, erklärt Tea Pavkov-Keller, Leiterin der Arbeitsgruppe. „Jene Stellen, an denen die Interaktionen stattfinden, können Angriffspunkte für Medikamente sein. Denn wenn Wirkstoffe dort Interaktionen verhindern, kann sich die Schutz-Hülle nicht mehr bilden“, führt die Wissenschaftlerin aus.
Dieses Wissen ist auch für andere Bereiche des Nano-Designs nützlich. S-Layer sind für die Entwicklung verschiedenster Anwendungen interessant, etwa Biosensoren oder Beschichtungen. Die genaue Kenntnis der Protein-Gitter-Struktur erlaubt es, ihnen durch gezielte Veränderungen ganz bestimmte Eigenschaften zu verleihen.
SymProFold kann von allen Wissenschaftler:innen für Forschungszwecke genutzt werden.
Die Forschungen sind Teil des Profilbereichs BioHealth der Universität Graz.
https://biohealth.uni-graz.at
Publikation:
SymProFold: Structural prediction of symmetrical biological assemblies
Christoph Buhlheller, Theo Sagmeister, Christoph Grininger, Nina Gubensäk, Uwe B. Sleytr, Isabel Usón, Tea Pavkov-Keller
Nature Communications, 18. 9. 2024
https://doi.org/10.1038/s41467-024-52138-3 (https://www.nature.com/articles/s41467-024-52138-3)